5° Klinischer Fall: Spontane elektromyographische Aktivität
5° Klinischer Fall: Spontane elektromyographische Aktivität
Zusammenfassung
Wenn es um Themen wie Orofazialschmerzen (OP) oder Temporomandibuläre Störungen (TMDs) geht, stößt man oft auf Aussagen, die mehr Aufmerksamkeit verdienen, wie zum Beispiel die Aussage über den Einfluss eines einseitigen posterior Kreuzbisses auf Veränderungen der spontanen Muskelaktivität in der Ruheposition des Kiefers und bei maximaler willkürlicher Kontraktion. Diese Aussagen führen zu einem tieferen Verständnis des Phänomens der spontanen Aktivität von Motorneuronen (MUs), was angesichts der Komplexität der Faktoren und Prozesse, die bei dieser klinischen Manifestation beteiligt sind, nicht trivial ist. Aus diesem Grund präsentieren wir einen 5. klinischen Fall: Spontane elektromyographische Aktivität bei einem überwiesenen Probanden mit früherer Diagnose von TMDs. Am Ende des Kapitels werden Sie unsere Empfehlung bezüglich einer verstärkten Aufmerksamkeit für das Experimentaldesign im Bereich der trigeminalen Neurophysiologie verstehen.
Einführung
In diesem Kapitel werden wir ein weiteres Thema behandeln, das viel diskutiert, aber auch viel verfolgt und als diagnostischer Test insbesondere bei Patienten mit Orofazialschmerzen (OP) und temporomandibulären Störungen (TMDs) vorgeschlagen wird: die Elektromyographie eines Muskels in Ruhezustand. Dies wirft sofort die bekannte hamletische Frage auf:
(... vielleicht!!)
Zieliński et al. [1]stellten fest, dass Veränderungen in den elektromyographischen Mustern der Kaumuskulatur mit dem Vorhandensein von Schmerzen aufgrund aktiver myofaszialer Triggerpunkte (MTrPs)[2][3][4][5][6] verbunden sein können und dass darüber hinaus während der elektromyographischen Untersuchung signifikant höhere Werte der Ruheaktivität innerhalb des vorderen Schläfenmuskels bei MTrPs und beobachtet wurden CMD-Patienten im Vergleich zu gesunden Personen. Die Autoren kommen zu dem Schluss, dass dieses veränderte Muster möglicherweise mit dem Vorhandensein aktiver MTrPs im Trapezmuskel zusammenhängt, die als Folge eines übertragenen Schmerzmechanismus die Aktivität des vorderen Schläfenmuskels (TA) verändern.
Darüber hinaus hat derselbe Autor [7]zahlreiche klinische Studien überprüft, die zeigen, dass Depressionen erhebliche Auswirkungen auf das stomatognathe System haben, einschließlich der Aktivität der Kaumuskulatur, was zu Kiefergelenksstörungen führen kann. Darüber hinaus wurde bei Probanden mit depressiven Symptomen [8] ein Anstieg der bioelektrischen Aktivität der Kaumuskeln beobachtet. Daher ist das Ziel der Studie von Zieliński et al. Ziel war es, , quantifiziert durch das Achse-II-Protokoll von RDC/TMD, auf die bioelektrische Ruheaktivität der Kaumuskeln und Schläfenmuskeln zu bestimmen. Die Schlussfolgerung war, dass eine mittelschwere Depression, die auf der Grundlage des RDC/TMDs-II-Achsenfragebogens ermittelt wurde, nicht mit der Ruheaktivität der ausgewählten Kaumuskeln zusammenhängt und dass weitere Untersuchungen an einer größeren Gruppe von Befragten durchgeführt werden sollten, um den Zusammenhang zwischen diesen zu ermitteln psychologische Faktoren und bioelektrische Parameter der Kaumuskulatur.
Unserer Meinung nach wäre es etwas komplex und vielleicht irrational, die Aktivität der Kaumuskeln im Ruhezustand bei Personen zu korrelieren, die an einer mehr oder weniger schweren Depression leiden, da das Phänomen der elektrischen Aktivität in den Ruhemuskeln im Jahr 2000 als „spontane Aktivität“ bezeichnet wird Im Fachjargon der Neurophysiologen handelt es sich um ein Phänomen mit einer nicht trivialen Erklärung. Wenn dieses Phänomen nicht zumindest weitgehend geklärt ist, kann die Vielzahl an physiopathogenetischen Interpretationen, die im Dentalbereich kursieren, zu einem diagnostischen Fehler führen.
Aus diesem Grund präsentieren wir einen klinischen Fall, der über orofaziale Schmerzen (OP) und Kiefergelenksstörungen (TMDs) berichtet, bei denen in früheren medizinischen Erfahrungen leider diagnostische Schwierigkeiten aufgetreten waren.
5° Klinischer Fall: Spontane elektromyographische Aktivität
65-jährige weibliche Patientin berichtet hauptsächlich über Orofazialschmerzen (OP) im linken Bereich des Gesichts, insbesondere über Schmerzen, die von den Massetermuskeln zum Kiefergelenk und zum linken Schläfenmuskel ausstrahlen. Etwa 2 Jahre nach einem plötzlichen Bewusstseinsverlust, als ihr Zahnarzt einen Trochlea für die Parodontologie des unteren linken Einwanderers durchführte, begannen plötzliche Schmerzen vom unzervikalen Typ und breiteten sich dann auf das gesamte linke Hemigesicht aus, auch beim Kauen. Kollegen stellten einen Zusammenhang mit dem Kauen fest und analysierten gemäß dem RDC-Protokoll und definierten die Patientin als an temporomandibulären Störungen (TMDs) leidend.
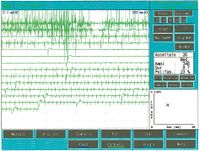
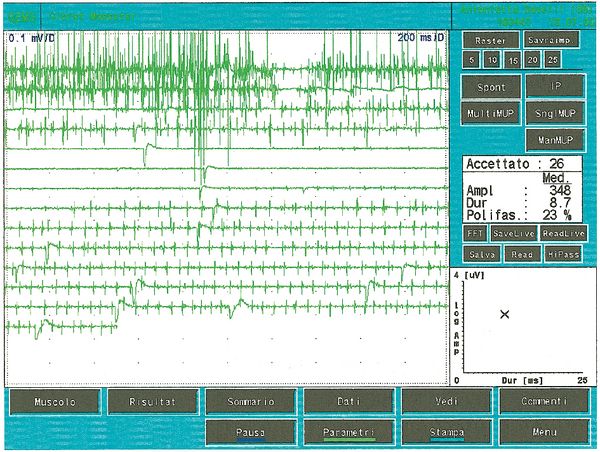
Als es uns zur Kenntnis kam, führten wir alle gnatologischen Tests durch (Axiographie, ATM-Bilder und Oberflächen-EMGs), die nicht für eine TMD sprachen, sondern für ein undefiniertes, aber im Wesentlichen neurologisches Bild. Der Grund für diese Interpretation war genau die Durchführung des Oberflächen-EMGs, das folgende Ergebnisse lieferte. Das elektromyographische Bild der Massetermuskeln wurde gemäß einer logischen Sequenz bestimmt, wie in Abbildung 1 dargestellt. Wie zu erkennen ist, war die laterale Asymmetrie der EMG-Aktivität mit Oberflächenelektroden der Massetermuskeln im entspannten Zustand (Abb. 1A), bei dem der Kiefer in Ruheposition gehalten wurde, so stark, dass eine Nadel-EMG des linken Masseters erforderlich war. Die mit dieser Technik aufgezeichnete Aktivität (Abb. 1B) zeigte eine Entladung mit einer stabilen Frequenz von 20 Hz, was eine Untersuchung der Motorneurone voraussetzte. Die Untersuchung der Motorneurone des linken Masseters (Abb. 1C) wählte automatisch 26 Motorneurone aus, deren Form, Dauer, Spitzen und Umdrehungen jedes Neurons analysiert wurden. Die Daten sind in der Tabelle (Abb. 1D) aufgeführt. Statistisch betrachtet können folgende Parameter erkannt werden: Durchschnittliche Amplitude von , eine Dauer von , polyphasischer Einheiten. Dieses klinische Bild stellt das typische pathophysiologische Phänomen dar, bei dem der Patient Schmerzen berichtet, aber die Diagnose oft "Schwierigkeiten bei der Muskelentspannung", "atypische Orofazialschmerzen" oder sogar besser "Fibromyalgie" bleibt und folglich die medikamentöse Therapie symptomatisch bleibt. Gerade diese Bedingungen sollten dem Arzt die Möglichkeit geben, seine Forschung zu vertiefen, indem er eine Koaxial-Nadel-EMG-Analyse durchführt und zumindest allgemeine Kenntnisse über deren Bestandteile hat, bevor er den Patienten an einen Neurologen überweist.
Schritte der Nadel-EMG
Die EMG-Untersuchung der Skelettmuskulatur besteht aus vier Schritten:
- Einführungsaktivität, wenn die Nadelelektrode in den Muskel eingeführt wird
- Spontane Aktivität, wenn der Muskel in Ruhe ist
- Motorische Einheitspotenziale, die durch isolierte motorische Entladungen während mäßiger willentlicher Kontraktion ausgelöst werden
- Rekrutierung oder Interferenzmuster während eines progressiven Kontraktionsniveaus
Einführungsaktivität
Bei einem Probanden erscheint die Einführungsaktivität als hochfrequente positive und negative Spitzen in einer einzigen Gruppe und ist typischerweise eine Darstellung von Muskelfaserschäden oder mechanischer Stimulation aufgrund des Nadelstichs in den Muskel. Bei unserem Patienten trat diese Aktivität mit einer Dauer von 80 ms auf und war auf ein normales Bild zurückzuführen. Beachten Sie auch das Phänomen der Plattenaktivität. Wenn eine Nadelelektrode an einer Stelle im Muskel festgehalten wird, zeigen normale, in Ruhe befindliche Muskeln absolut keine elektrische Aktivität, außer im Bereich der neuromuskulären Endplatte. Diese bestehen aus zwei Komponenten: geringe Amplitude (im Bereich von 10-50 μV) und kurze Dauer (1-2 ms), die dem Lautsprecher-EMG ähneln, das an das Geräusch von Muscheln am Ohr erinnert. In unserem Fall (Abbildung 1A) kann das vollständige Fehlen von Plattenaktivität im rechten Massetermuskel durch die Aufzeichnung mit Oberflächenelektroden erklärt werden, die die Energie des Signals teilweise reduzieren, aber die auf dem linken Masseter aufgezeichnete Aktivität, wieder mit Oberfläche, eine Breite von aufweist. Aus dem gleichen Grund sollte diese Aktivität nicht als Plattenaktivität betrachtet werden, da, wie in Abbildung 1B zu sehen ist, die Aufzeichnung des linken Masseters mit einer Koaxialnadel eine Amplitude von aufweist. Manchmal sind Plattenpotenzialspitzen im Wellenform von Fibrillationspotenzialen nicht zu unterscheiden, die auch eine anfängliche Negativität zeigen, wenn sie in der Nähe der Platte aufgezeichnet werden. Ein weiteres interessantes Element ist die Ähnlichkeit des Entlademodells zwischen den Entladungen der neuromuskulären Spindeln und der Plattenpotenziale, sodass einige Autoren[9] vermuteten, dass diese Potenziale aus den intrafusalen Muskelzellen stammen könnten. Die Diskussion und die elektrophysiologische Bedeutung der in Abbildung 1B beobachtbaren elektrischen Aktivität sollten näher erläutert werden.
Spontane Aktivität
In den ersten 2 Wochen nach der Denervierung erhöht sich die Sensitivität einer Muskelfaser gegenüber Acetylcholin (ACh) um das bis zu 100-fache. Dieses Phänomen, bekannt als "Denervierungshypersensitivität", könnte die spontane Aktivität denervierter Muskelfasern als Reaktion auf minimale ACh-Quanten erklären.[10]
Die Tatsache, dass die Infusion von Curare die Rezeptoren der neuromuskulären Platte blockiert, aber die spontane Entladung nicht abschaltet, dass die Denervierung des Froschmuskels zu einer erhöhten Empfindlichkeit gegenüber ACh führen kann, aber keine spontane Aktivität erzeugt.[11]
Diese Studien haben eine alternative Hypothese vorgeschlagen, nämlich langsame Veränderungen in den Membranpotenzialen metabolischen Ursprungs, die periodisch ein kritisches Niveau erreichen und propagierte Spikes auslösen können.[12]
Diese Studien haben eine alternative Hypothese vorgeschlagen, nämlich langsame Veränderungen der Membranpotenziale, die metabolischen Ursprungs sind und periodisch ein kritisches Niveau erreichen können und propagierte Spikes auslösen können. Typische Phänomene spontaner Aktivität umfassen jedoch Fibrillationspotenziale, positive Spikewellen, Faszikulationspotenziale, myochemische Entladungen und komplexe repetitive Entladungen. Ohne zu sehr auf spezialisierte Themen einzugehen und die elektrophysiologischen Aufzeichnungen des klinischen Falls zu berücksichtigen, genügt es, sich mit positiven Spikewellen, Fibrillationen und Faszikulationen zu befassen. Positive Spitzenwellen sind Sägezahnentladungen, die spontan und kontinuierlich entladen werden.
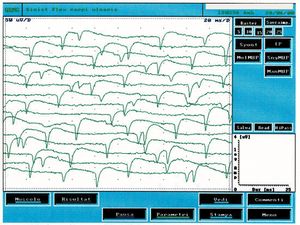
Diese Art von Aktivität findet sich in denervierten Muskeln, aber auch in einer Vielzahl von myogenen Zuständen. In Abbildung 2 ist es möglich, eine typische Aufzeichnung der spontanen Aktivität von positiven Spitzenwellen zu beobachten, die im Vergleich zum klinischen Fall unter Untersuchung (Abbildung 1B) deutlich unterschiedlich sind. Unter Fibrillation verstehen wir hingegen Potenziale mit einer Dauer von und einer Amplitude von etwa mit biphasischen oder triphasischen Wellenformen und anfänglicher Positivität. Fibrillationspotenziale, die durch spontane Schwingungen im Membranpotenzial ausgelöst werden, feuern typischerweise mit Frequenzen von und einem Durchschnitt von . Dieses Phänomen stellt die spontane Aktivität eines oder mehrerer Muskelgewebe dar und ist pathognomonisch für eine Denervation, obwohl es auch in gesunden Muskeln auftreten kann. Das Vorhandensein reproduzierbarer Entladungen in mindestens zwei verschiedenen Bereichen des Muskels deutet in der Regel auf eine sekundäre motorische Neuronenstörung hin, die Pathologien der vorderen Hornzellen, Radikulopathien, Plexopathien, axonale Mono- und Polyneuropathien sowie bestimmte Myopathien umfasst.
In Abbildung 3 können wir eine typische Spur spontaner Aktivität aus Denervation beobachten und sie mit der Spur in Abbildung 1C vergleichen, in der elektrophysiologische Unterschiede festgestellt werden können. Die spontane Fibrillationsaktivität hat eine Amplitude von etwa , die Frequenz von erscheint zufällig, während im berichteten klinischen Fall (Abbildung 1C) die Amplitude etwa betrug und die höchste Frequenz, aber besonders stabil war und fast einen zentralen Schrittmacher signalisierte.
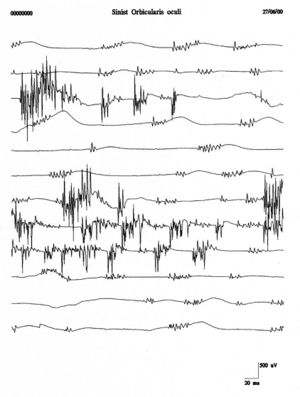
Um terminologische und klinische Verwirrung zwischen Fibrillation und Faszikulation zu vermeiden, schlugen Danny-Brown und Pennybacker vor,[13] den Begriff Faszikulation zu verwenden, um den spontanen Zucken von motorischen Einheiten zu beschreiben. Faszikulationen stellen daher die spontane Entladung einer Gruppe von Muskelfasern dar, die auf den gesamten oder teilweisen Teil der motorischen Einheit zurückzuführen ist. Das isolierte Feuern einer motorischen Einheit mit komplexen Salven wiederholter Entladungen verursacht wurmförmige Bewegungen der Haut, die als Myokymie bezeichnet werden.[14]
Wiederholte Entladungen derselben motorischen Einheit treten in Salven in regelmäßigen Abständen von bis 10 Sekunden auf, wobei in jeder Salve Spike-Entladungen mit einer Frequenz von auftreten. Faszikulationspotenziale sind typischerweise mit Pathologien der vorderen Hornzellen verbunden, werden jedoch auch bei Radikulopathien, Nerveneinklemmungen und dem Muskelschmerz-Faszikulationssyndrom beobachtet. Abbildung 4 zeigt ein deutliches Beispiel für Faszikulationen des Musculus orbicularis oculi, das im Vergleich zu den Aufzeichnungen des klinischen Falls (Abbildung 1B und C) eine vollständige morphologische Vielfalt und zeitliche Darstellung aufweist. Diese Vielfalt würde die Ausschlussdiagnose einer Denervationspathologie stärken.
Motorische Einheit Potenziale
Eine motorische Einheit kann anhand der Amplitude, Anstiegszeit, Dauer und Phasen definiert werden, wie später im Kapitel 'Elektromyographie' näher beschrieben wird. Die aufgezeichnete Amplitude variiert stark mit der Position der Elektrodenspitze relativ zur entladenen Ionenstromquelle, daher wählt ein erfahrener Bediener ein Motorischeinheitspotential mit einer Anstiegszeit von etwa aus, um sicher nahe an der Quelle zu sein. Die Amplitude im normalen Bereich reicht von Hunderten von bis zu einigen und die Dauer beträgt . Für die Gesichtsmuskeln beziehen wir uns insbesondere auf die von Buchthal[15]angegebenen Werte, deren Bereich bei maximal Jahren zwischen liegt. Biphasische oder triphasische motorische Einheitspotenziale sind auch in normalen Muskeln vorhanden, und zwar durchschnittlich bei der motorischen Einheiten mit oder mehr Phasen.
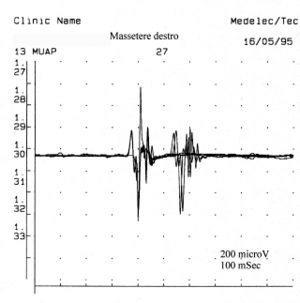
Die Anzahl der polyphasischen Einheiten nimmt sowohl bei Myopathien, Neuropathien als auch bei Pathologien der Motoneurone zu. Polyphasie zeigt daher eine zeitliche Streuung der Muskelzellpotenziale innerhalb einer motorischen Einheit an. Bei einigen Abnormalitäten, sogenannten Doppel- oder Dreifachentladungen, feuert eine motorische Einheit zwei- oder dreimal in sehr kurzen Zeitintervallen und repräsentiert einen metabolischen Störungszustand, der mit einer Hypererregbarkeit des motoneuralen Pools verbunden ist. In Abbildung 5 können wir eine typische Aufzeichnung minimaler willkürlicher Aktivität polyphasischer MUAP und eine Doppelentladung beobachten, die einen Zustand der motorischen Neuronenpathologie darstellt. Vergleicht man diese Aufzeichnung der pathologischen motorischen Einheit mit einigen der Abbildungen 1C, insbesondere den 5,7,13 und 23, mit den Werten der jeweiligen Amplitude von 678 μV; 419 μV3; 686 μV und 530 μV, sowie der Dauer von 8,2, 4,2, 6,2 ms und 8,4 ms, können wir feststellen, dass die aufgezeichnete Aktivität am linken Massetermuskel des fraglichen klinischen Falls keine elektrophysiologischen Merkmale aufweist, die mit einem Schädigungsbild des II. Motoneurons übereinstimmen können.
Die Anzahl der polyphasischen Einheiten nimmt sowohl bei Myopathien, Neuropathien als auch bei Pathologien der Motoneurone zu. Polyphasie zeigt daher eine zeitliche Streuung der Muskelzellpotenziale innerhalb einer motorischen Einheit an. Bei einigen Abnormalitäten, sogenannten Doppel- oder Dreifachentladungen, feuert eine motorische Einheit zwei- oder dreimal in sehr kurzen Zeitintervallen und repräsentiert einen metabolischen Störungszustand, der mit einer Hypererregbarkeit des motoneuralen Pools verbunden ist. In Abbildung 5 können wir eine typische Aufzeichnung minimaler willkürlicher Aktivität polyphasischer MUAP und eine Doppelentladung beobachten, die einen Zustand der motorischen Neuronenpathologie darstellt. Vergleicht man diese Aufzeichnung der pathologischen motorischen Einheit mit einigen der Abbildungen 1C, insbesondere den 5,7,13 und 23, mit den Werten der jeweiligen Amplitude von , sowie der Dauer von , können wir feststellen, dass die aufgezeichnete Aktivität am linken Massetermuskel des fraglichen klinischen Falls keine elektrophysiologischen Merkmale aufweist, die mit einem Schädigungsbild des II. Motoneurons übereinstimmen können.
Interferenzmuster
Die Kontraktionsintensität erhöht die Anzahl der Motorneuronen, die sehr schnell zu feuern beginnen, was die Identifizierung einzelner motorischer Einheitspotenziale ausschließt. Dieses Phänomen wird als Interferenzmuster bezeichnet. Die Dichte der Spitzen und die durchschnittliche Amplitude der summierten Reaktionen werden von einer Reihe von Faktoren bestimmt, wie z.B.: die absteigende Ausgabe aus der Großhirnrinde, die Anzahl der fähigen Motorneuronen, die Feuerrate jeder motorischen Einheit, die Wellenform einzelner Potenziale und die Wahrscheinlichkeit der Phasenlöschung (Kollision). In unserem klinischen Fall war das auf den Massetermuskeln aufgezeichnete Interferenzmuster sowohl in der Amplitude als auch in der Frequenz normal.
Aus der detaillierten Analyse der EMG-Aufzeichnung im Zusammenhang mit dem beschriebenen klinischen Fall können wir die Abwesenheit eines organischen Schadens an der motorischen Einheit und/oder den Muskelzellen aus verschiedenen Gründen bestätigen, wie z.B.: das Fehlen von spontaner Aktivität, die normale Morphologie der motorischen Einheit und die interferenziale Rekrutierung. Die Interpretation der auf dem linken Massetermuskel aufgezeichneten EMG-Aktivität (Abbildung 1) bleibt jedoch noch offen, da sie sich, unter Bezugnahme auf die oben beschriebenen Konzepte, nicht als "spontane Aktivität" bezeichnen lässt, da sie keine Ausdrucksform der Denervation ist, noch als "Fehlen der Muskelentspannung", da der Patient den Muskel weder freiwillig noch mit Dehnübungen entspannen kann, noch als "EMG-Aktivität in Ruhe aufgrund psychischer Störung", da die psychometrischen Tests negativ sind.
Pharmakologische experimentelle Studie
Es wurde eine experimentelle Studie vorgeschlagen, mit Einverständnis des Patienten, bei der versucht wurde, die neuronale Aktivität des Hirnstamms pharmakologisch von der kortikalen Aktivität zu entkoppeln. Gleichzeitig mit der pharmakologischen Entkopplung wurde die EMG-Aktivität mit einer koaxialen Nadel am linken Masseter überwacht und kontextuell der Lidschlussreflex. Das experimentelle Modell, das wir kurz erläutern werden, wurde durch zwei wesentliche Elemente geschaffen, nämlich: die Wahl des spezifischen Anästhetikums für den Zweck der Studie (Propofol) und die Kontrolle der elektrophysiologischen Aktivität des Hirnstamms durch den Lidschlussreflex.
Propofol
Die Wirkungen von Anästhetika führen zu Bewusstseinsverlust, Gedächtnisverlust, Veränderungen der spontanen Aktivität, Dämpfung der Schutzreflexe, Verlust der posturalen Reflexe und auch zu unerwünschten Wirkungen wie Halluzinationen, Euphorie und Amnesie. Darüber hinaus können sie den Spiegel oder die Homöostase von Neurotransmittern im Gehirn wie Dopamin, Noradrenalin und Acetylcholin (ACh) beeinflussen.[16] ACh war der erste Neurotransmitter, der beschrieben wurde, und cholinerge Neuronen sind weit im Gehirn verteilt. Cholinerge Mechanismen sind bekanntermaßen wichtig im Striatum, wo ein Gleichgewicht zwischen Dopamin- und ACh-Freisetzung für normale motorische Ausgabe sorgt,[17] im Hippocampus und im frontalen Cortex, wo ACh eine wichtige Rolle bei der Regulation von Bewusstsein und Gedächtnis spielt.
Propofol verstärkt wahrscheinlich die hemmende Wirkung von GABAA-Rezeptoren und hat eine andere Wirkung als Barbiturate oder Benzodiazepine. Eine elegante Studie,[18] die mittels intrazerebraler Mikrodialyse bei Mäusen durchgeführt wurde, zeigte, dass Propofol in Dosen von 50 mg/kg die Freisetzung von ACh aus dem frontalen Cortex um 85 %, aus dem Hippocampus um 72 % und aus dem Striatum um 19 % verringerte.
Lidschlussreflex
Der Lidschlussreflex wird durch einen Schlag auf den Augenbrauenbereich auf einer Seite der Stirn ausgelöst. Elektrophysiologisch ist es möglich, ihn durch Anwendung eines elektrischen Reizes auf den Augenbrauenbogen in Höhe des Supraorbitalforamens hervorzurufen. Die Reaktionen werden durch zwei Oberflächenelektroden auf dem M. orbicularis oculi auf jeder Seite aufgezeichnet, und die motorischen Potenziale können hauptsächlich durch zwei Ereignisse dargestellt werden, nämlich die ipsilaterale R1-Reaktion auf die Stimulation und die bilaterale R2-Reaktion. Diese Reaktionen stellen eine monosynaptische und polysynaptische Schaltung für R1 bzw. R2 dar. Die R1-Reaktion wurde angenommen, einem trigeminalen Pfad im Pons zu folgen, während die R2-Reaktion über einen Pfad in der Nähe der retikulären Formation die Gesichtskerne erreicht..[19][20][21]
Die Hauptneuralschaltung des Lidschlussreflexes befindet sich im Hirnstamm, aber jüngste Arbeiten haben mit funktioneller Magnetresonanztomographie (fMRT) gezeigt, dass während des Lidschlussreflexes bei Menschen zwei Hauptbereiche im hinteren Lappen des Kleinhirnhemisphären, hauptsächlich auf der Seite ipsilateral zur Stimulation, aktiviert werden.[22]
Experimenteller Ablauf
Das Experiment bestand darin, gleichzeitig die Präsenz des Lidschlussreflexes (R1 und R2) und die EMG-Aktivität des linken Masseters mit einer Nadelelektrode während der Propofol-Infusion in Dosen von zu überwachen, was eine leichte Dissoziation - Wachsamkeit und mit offenen Augen - verursachte. Auf diese Weise kann mit guter Annäherung festgestellt werden, dass das Medikament die mesenzephal-bulbären Funktionen freisetzte.
Die EMG-Reaktionen (Abb. 6) waren wie folgt: Beim Einbringen des Medikaments kam es zu einem kurzen bewussten Verlust der kortikalen Kontrolle, den Anästhesisten klinisch als vorübergehende Hypertonie kennen und der elektrophysiologisch zu einer Zunahme des Muskeltonus führt. In Abbildung 6 (Phase 1: die ersten beiden oberen Spuren) können wir den Anstieg der Entladungsfrequenz der motorischen Einheiten von etwa vor dem Experiment (Abb. 1B) auf etwa in Phase 1 beobachten. (Abb. 6, Spur 1 und 2 oben)
Nach etwa scheint sich das Medikament in die kortikal-subkortikalen Bereiche verteilt zu haben, und dieser Effekt zeigt sich elektrophysiologisch durch eine Verlangsamung der EMG-Entladungsfrequenz (Abb. 6, Spuren 3 und 4, beginnend von oben). Nach weiteren etwa ist die Sättigung der kortikalen und vermutlich subkortikalen Bereiche vollständig, und es gibt eine vollständige Abwesenheit von EMG-Aktivität am linken Masseter (Abb. 6, Spuren 5, 6 und 7, beginnend von oben). Schließlich wird das Medikament nach etwa metabolisiert, nachdem die elektrische Stille eintritt, und gleichzeitig tritt die konstante EMG-Tonaktivität wieder mit etwa auf (Abb. 6, Spuren 8-14).
Schlussfolgerungen
Experimentelle Schlussfolgerung
Die EMG-Aktivität, die beim untersuchten Probanden vorhanden ist, kann nicht als "Spontanaktivität" bezeichnet werden, da sie keine Merkmale eines organischen Schadens an den Muskelzellen und/oder dem zweiten Motoneuron zeigt. Wenn es sich um einen Muskelschaden handeln würde, wäre die EMG-Aktivität auch nach der Verabreichung von Propofol bestehen geblieben. Tatsächlich wurde beobachtet, dass Dosen von Propofol die Faszikulationen, die durch die Verabreichung von 1 mg/kg Succinylcholin verursacht wurden, nicht rückgängig machten.[23] Die EMG-Aktivität, die beim Probanden vorhanden ist, kann auch nicht als "Unfähigkeit zur Entspannung" beschrieben werden, da der Begriff zu allgemein ist, um auf Zustände psychischer Störungen und dystoner Störungen zu verweisen. Bei oromandibulären Dystonien gibt es tatsächlich Phasen der EMG-Stille, wenn der Patient aufgefordert wird, den Kiefer zur Seite zu bewegen, um den beteiligten Muskel zu dehnen. Dieser Effekt wird durch eine zusätzliche Eingabe von den propriozeptiven Fasern des Muskels bestimmt.
Das Verschwinden der EMG-Aktivität bei Dosen von Propofol, einer Dosis, die in der Lage ist, mit den kortikalen, subkortikalen und striatalen Systemen zu interferieren, während gleichzeitig die Funktionen des Hirnstamms und des Ponto-Bulbären intakt bleiben, zeigt, dass der Schrittmacher auf einer höheren Ebene des Hirnstamms liegt.
Die aufgezeichnete EMG-Aktivität kann schließlich als "unwillkürliche EMG-Aktivität" definiert werden und reagiert auf einen zentralen Schrittmacher. Diese kontinuierliche EMG-Aktivität würde langfristig zu Schäden an den Myofibrillen und Myoglobin führen, wobei Myoglobin eine algogene Substanz ist und die letztendliche Ursache für die vom Patienten berichteten Schmerzen darstellen würde.
Daher war es wahrscheinlicher, dass der Patient von "Fokaler oromandibulärer Dystonie" als von "Temporomandibulären Störungen", begleitet von Bruxismusphänomenen auch tagsüber, betroffen war. Pharmakologische Beweise legen nahe, dass das zentrale dopaminerge System an der Pathogenese der kraniocervikalen Dystonie und des Bruxismus beteiligt sein könnte.[24]Tatsächlich zeigte Lobbezo anhand von PET-Bildgebung eine abnormale laterale Verteilung von striatalen D2-Bindungsrezeptoren bei Bruxismus und kraniocervikalen Dystonien.[25] Die Tatsache, dass periphere Traumata Dystonie verursachen können, legt nahe, dass das sensorische System für die Pathogenese der fokalen Dystonie wichtig sein könnte und sich in jedem Fall nur dann auswirken kann, wenn der Patient genetisch predisponiert ist, eine posttraumatische Dystonie zu entwickeln.[26] Unter Verwendung von PET können thermische Schmerzreize an der Hand und die intradermale Injektion von Capsaicin eine Zunahme des Blutflusses im kontralateralen Putamen und Globus pallidus im Vergleich zu schmerzlosen thermischen Reizen bewirken.[27][28] Darüber hinaus ist die Expression der Gene für Prodynorphin, c-Fos und c-Jun auf spinaler und mesenzephaler Ebene nach schmerzhaften Reizen verändert.[29] Bei Dystonikern wurde unter Verwendung von PET eine signifikante Reduktion des maximalen Blutflusses in Reaktion auf die Vibration der Hand sowohl in den primären sensorischen als auch in den zusätzlichen motorischen Kortex im Vergleich zu normalen Probanden festgestellt. [30] Dystonische Manifestationen bei den Patienten wurden leicht durch den "tonischen Vibrationsreflex" ausgelöst, waren jedoch durch eine Lidocain-Blockade der Muskelspindeln deutlich vermindert.[31]
Diese Autoren schlugen drei Mechanismen vor, die die erhöhte Empfindlichkeit gegenüber Vibration erklären könnten: den Verlust der normalen Hemmung der Ia-Afferenzen, eine "zentrale" Veränderung und eine Veränderung der Erregbarkeit der neuromuskulären Spindeln aufgrund einer Überaktivität der Motoneuronen. Der Verlust der normalen Hemmung wurde auch in anderen Experimenten gefunden; bei Dystonikern gibt es tatsächlich eine schnelle Erholungskurve des Blinkreflexes und der H-Welle.[32]
Pharmakologische Behandlung
Der Patient reagierte positiv auf die Verabreichung von "SIRDALUD" in einer Dosierung von 4 mg dreimal täglich im Vergleich zur Verabreichung von Diazepam. Tizanidin (Sirdalud) ist tatsächlich ein Molekül, das zentral als myotonolytisches Mittel wirkt und sich pharmakologisch und chemisch von Diazepam und Baclofen unterscheidet. Dieses ist ein potenter Inhibitor von und -Motoneuronen bei experimentell induzierter Steifheit bei Mäusen und polysynaptischer Aktivität bei Katzen. Bei dekortizierten oder dekerebrierten Katzen hemmt Tizanidin bevorzugt die tonische Komponente der Reflexaktivität. Die Wirkungen von Tizanidin resultieren aus seiner agonistischen Aktivität an Noradrenergic-Untereinheiten-Rezeptoren und können auch die Hemmung der Freisetzung von erregenden Aminosäuren aus spinalen Interneuronen (EAAs) umfassen.[33] Die Wirkung auf den Muskeltonus, die geringere sedative Wirkung im Vergleich zu Diazepam und Baclofen sowie die daraus resultierende geringere Muskelschwäche sind die Merkmale, die zur Wahl dieses Arzneimittels gegenüber den anderen (EAAs) geführt haben.
Klinische Schlussfolgerungen
Um zu einer klaren und bedeutungsvollen klinischen Schlussfolgerung zu gelangen, müssen wir uns folgende Frage stellen:
Verursachen die temporomandibulären Störungen eine funktionelle Veränderung des trigeminalen zentralen Nervensystems, oder könnte diese klinische Manifestation eine Variante einer gutartigen akuten kranialen Polyneuritis oder einen komplexeren klinischen Zustand darstellen?
Eine angemessene Antwort auf diese Frage wurde durch eine Studie von Adour KK[34] in einer prospektiven Studie mit neurootologischer Untersuchung und Elektromyographie gegeben. Sieben aufeinander folgende Patienten mit den Hauptsymptomen des Schmerzsyndroms des Kiefergelenks (Schmerz, Zärtlichkeit, Klicken und Einschränkung der Kieferbewegung) wurden innerhalb einer Woche nach Beginn ihrer akuten Symptome bewertet. Drei weitere mit chronischen Symptomen wurden zur Vergleichsuntersuchung mit akuten Fällen getestet. Alle sieben Patienten mit der akuten Erkrankung hatten asymptomatische Hypästhesie aller drei Abteilungen des Trigeminusnervs und eine verminderte Aktionspotentialaktivität der willkürlichen Muskeln im Masseter- und Schläfenmuskel. Am Ende von drei Wochen verschwand die Hypästhesie bei allen sieben Patienten, und das Aktionspotential der Muskeln normalisierte sich bei sechs der sieben. Die EMG-Untersuchung des einzigen Patienten mit persistierend verminderten Muskelaktionspotenzialen und drei Patienten mit chronischen Symptomen zeigte Fibrillation, verminderte polyphasische Regenerationspotenziale und spontane Faszikulationen mit klinischer Atrophie und Spasmus der betroffenen Masseter- und Schläfenmuskeln. Andere akute Hirnnervenbefunde umfassten unilaterale Glossopharyngeal- und zweite zervikale Nerven-Hypästhesie, motorische Lähmung des oberen Kehlkopfnervenzweigs des Vagusnervs und erhöhte Latenz des Gesichtsnervs. Diese Befunde legen eine neuromuskuläre, anstelle einer psychophysiologischen, organischen Ursache für das Schmerzsyndrom des Kiefergelenks nahe.
Entgegen dieser Behauptung, die eine organische neuromotorische Störung als Grundlage einer klinischen Situation von TMDs sieht, gibt es die Ansicht, dass der Einfluss des unilateralen posterioreren Kreuzbisses auf die Variationen der spontanen Muskelaktivität in der mandibulären Ruheposition und bei maximaler willkürlicher Kontraktion signifikant ist und von Woźniak K et al. bestätigt wurde.[35]
Nachdem wir bereits die terminologischen, klinischen und wissenschaftlichen Schwierigkeiten bei der Interpretation von Phänomenen, die eine Veränderung des trigeminalen Zentralnervensystems in der EMG-Aktivität in Ruhe darstellen, wenn auch nicht im Detail, geklärt haben, können wir nur mehr Aufmerksamkeit bei der Planung von Experimenten dieser Art vorschlagen. Zum Beispiel gelangt Woźniak K et al.[35] zu diesen Schlussfolgerungen, indem sie die Asymmetrie zwischen den Seiten der EMG-Aktivität in Ruhe und bei maximaler Willensanstrengung zur Kontraktion (MVC) analysieren, und der verwendete Algorithmus lautet wie folgt:
Wir haben jedoch nicht berücksichtigt, ob diese Asymmetrien, die hauptsächlich im Zähler deutlich werden, tatsächlich mit einer organischen Symmetrie der trigeminalen motorischen Wurzeln zusammenhängen. Daher hätten diese Schlussfolgerungen exponentiell signifikanter werden können, wenn sie mit den Ausgangsdaten aus der Durchführung der bilateralen trigeminalen motorischen ausgelösten Potenziale (bRoot-MEPs) korreliert worden wären, die von unserer Gruppe durchgeführt wurden.
Dies hätte eine exponentielle klinische Bedeutung gehabt, da es eine Korrelation zwischen der funktionellen (und nicht-organischen) Asymmetrie zwischen dem Kreuzbiss und den neuromotorischen elektrischen Aktivitäten bestätigt hätte.
- ↑ Zieliński G, Byś A, Szkutnik J, Majcher P, Ginszt M, «Electromyographic Patterns of Masticatory Muscles in Relation to Active Myofascial Trigger Points of the Upper Trapezius and Temporomandibular Disorders», in Diagnostics (Basel), 2021».
PMID:33805008 - PMCID:PMC8063936
DOI:10.3390/diagnostics11040580
This is an Open Access resource! - ↑ Fernández-de-Las-Peñas C, Galán-Del-Río F, Alonso-Blanco C, Jiménez-García R, Arendt-Nielsen L, Svensson P, «Referred Pain from Muscle Trigger Points in the Masticatory and Neck-Shoulder Musculature in Women with Temporomandibular Disoders», in J Pain, Elsevier, 2010».
PMID:20494623
DOI:10.1016/j.jpain.2010.03.005 - ↑ Peck C, Murray G, Gerzina T, «How Does Pain Affect Jaw Muscle Activity? The Integrated Pain Adaptation Model», in Aust Dent J, 2008».
PMID:18782363
DOI:10.1111/j.1834-7819.2008.00050.x - ↑ Pietropaoli D, Ortu E, Giannoni M, Cattaneo R, Mummolo A, Monaco A, «Alterations in Surface Electromyography Are Associated with Subjective Masticatory Muscle Pain», in Pain Res Manag, 2019».
PMID:31885756 - PMCID:PMC6893259
DOI:10.1155/2019/6256179
This is an Open Access resource! - ↑ Manfredini D, Cocilovo F, Favero L, Ferronato G, Tonello S, Guarda-Nardini L, «Surface Electromyography of Jaw Muscles and Kinesiographic Recordings: Diagnostic Accuracy for Myofascial Pain», in J Oral Rehabil, Blackwell Publishing Ltd, 2011, Hoboken, New Jersey, USA».
PMID:21480942
DOI:10.1111/j.1365-2842.2011.02218.x - ↑ Simons DG, Travell JG, Simons LS, «Travell & Simons’ Myofascial Pain and Dysfunction: The Trigger Point Manual», Williams & Wilkins, 1999, Baltimore, MD, USA».
ISBN: 978-0683083637 - ↑ Zieliński G, Byś A, Ginszt M, Baszczowski JS, Majcher P, Gawda P, «Depression and Resting Masticatory Muscle Activity», in J Clin Med, 2020».
PMID:32290557 - PMCID:PMC7230290
DOI:10.3390/jcm9041097
This is an Open Access resource! - ↑ Stocka A, Sierpinska T, Kuc J, Golebiewska M, «Relationship between depression and masticatory muscles function in a group of adolescents», in Cranio, 2018».
PMID:28823222
DOI:10.1080/08869634.2017.1364030 - ↑ Partanen JV, Nousiainen U, «End-plate spikes in the electromyography are fusimotor unit potentials», in Neurology, 1983».
PMID:6683798
DOI:10.1212/wnl.33.8.1039 - ↑ Axelsson J, Thesleff S, «A study of super-sensitivity of denervated mammalian skeletal muscles», in J Physiol, 1959».
PMID:13673396 - PMCID:PMC1357014
DOI:10.1113/jphysiol.1959.sp006233 - ↑ Miledi R, «The acetylcholine sensitivity of frog musclefibres after complete or partial denervation», in J Physiol, 1960».
PMID:14422356 - PMCID:PMC1363214 - ↑ Thesleff S, «Fibrillation in denervated mammalian skeletal muscle», Oxford University Press, 1982, Oxford – in «Cukp WL e Ochoa J (eds): «Abnormal Nerves and Muscle as Impulse Genertors»».
- ↑ Danny-Brown D, Pennybacker JB.: Fibrillation and fasciculation in voluntary muscle. Brain 1938; 61: 311-332
- ↑ Sindermann F,Conrad B, Jacobi HM, Prochazka VJ.: Unusual properties of repetitive fasciculation Elctroencephalogr Clin Neurophysiol 1973; 35: 173-179
- ↑ Buchtal F: An introduction to electromyography Scandinavian University Books. Copenhagen 1957
- ↑ Angel A. : Central neuronal pathways and the process of anaesthesia. British Journal of Anaesthesia 1993; 71:148-163
- ↑ Iversen SD.: Behavioural evaluation of cholinergic drug. Life Sciences 1997; 60: 1145-1152
- ↑ Kikuchi T, Wang Y, Sato K, Okumura F.: In vivo effects of propofol on aceylcholine release from the fronatl cortex, hippocampus and striatum studied by intracerebral microdialysis in freely moving rats
- ↑ Ongerboer de Visser BW, Kuypers HG (1978): Late blink reflex changes in lateral medullary lesions. An electrophysiological and neuro-anatomical study of Wallenberg's syndrome. Brain 101: 285-294.
- ↑ Ongerboer de Visser BW (1983b): Comparative study of corneal and blink reflex latencies in patients with segmental or with cerebral lesions. In: Desmedt JE , editor. Advances in neurology. New York: Raven Press. p 757-772.
- ↑ Ongerboer de Visser BW (1983b): Comparative study of corneal and blink reflex latencies in patients with segmental or with cerebral lesions. In: Desmedt JE , editor. Advances in neurology. New York: Raven Press. p 757-772.
- ↑ Dimitrova A, Weber J, Maschke M, Elles HG, Kolb FP, Forsting M, Diener HC, Timmann D. Eyeblink-related areas in human cerebellum as shown by fMRI. Hum Brain Mapp. 2002 Oct;17(2):100-15.
- ↑ Kararmaz A. Kaya S, TurhanogluS, Ozyilmaz A.: Effects of high-dose propofol on succinylcholine-induced fasciculations and myalgia. Acta Anaesthesiol Scand 2003; 47:180-184
- ↑ Watt MW, Tan EK, Jankovic J.: Bruxism and Cranial cervical dystonia: Is there a relationship? Behavioural Sciences. 1999; 17: 196-2011)
- ↑ Lobbezzo F, Soucy JP, Montplaisir JY, Lavigne GJ.: Striatal D2 receptor binding in sleep bruxism: a controlled study with iodine 123 –iodobenzamide and single photon emission computer tomography. J Dent. Res. 1996 : 75 ; 1804-1810
- ↑ Chuldler EH, Dong WK.: The role of basal ganglia in nociception and pain Pain 1995; 60: 3-38
- ↑ Jones AK, Brown WD, Friston KJ, Qi LY,Frackowiak RS.: Cortical and subcortical localization of response to pain in man using positron emission tomography. Proc R Soc Lond B Biol Sci 1991; 244: 39-44
- ↑ Iadarola MJ, Berman KF, Byas-Smith M, Gracely RH, Max M, Seffiro T. et all.: Positron emission tomography (PET) studies of pain and allodynia in normal and patients with chronic neuropathic pain. Soc Neurosci Abstr 1993; 19: 1074
- ↑ Bullitt E.: Introduction of c-Foslike protein whitin the lumbar spinal cord and thalamus of the rat following peripheral stimulation. Brain Res 1989; 493: 391-7
- ↑ Tempel LW, Perlmutter JS.: Abnormal cortical responses in patients with writer’s cramp Neurology 1993; 43: 2252-7
- ↑ Kaji R, Rothwell JC, Katayama M, Ikeda T, Kubori T, Kohara N, Mezaki T, Shibasaki H, Kimura J.: Tonic vibration reflex and muscle afferent block in writer's cramp. Ann Neurol. 1995 Aug;38(2):155-62
- ↑ Tolosa E, Montserrat L, Bayes A.: Blink reflex studies in focal dystonias: enhanced excitability of brainstem interneurons in cranial dystonia and spasmodic torticollis. Mov Disord. 1988;3(1):61-9
- ↑ Coward DM: The drug treatment of spasticity. Sandoz 1997
- ↑ Adour KK. Acute temporomandibular joint pain-dysfunction syndrome: neuro-otologic and electromyographic study. Am J Otolaryngol. 1981 May;2(2):114-22. doi: 10.1016/s0196-0709(81)80028-2.PMID: 7270801
- ↑ 35.0 35.1 Woźniak K, Szyszka-Sommerfeld L, Lichota D. The electrical activity of the temporal and masseter muscles in patients with TMD and unilateral posterior crossbite. Biomed Res Int. 2015;2015:259372. doi: 10.1155/2015/259372. Epub 2015 Mar 26.PMID: 25883948