7° Klinischer Fall: Hirnstammneoplasie bei orofazialen Schmerzen
7° Klinischer Fall: Hirnstammneoplasie bei orofazialen Schmerzen
Dieses Kapitel stellt einen Fall von absoluter epistemologischer Bedeutung dar, da es eine Lücke im diagnostischen Prozess aufzeigt, der auf evidenzbasierter Medizin (EBM) beruht. Dieser letzte Begriff ist tatsächlich untrennbar mit dem grundlegenden wissenschaftlichen Wissen verbunden, das bereits als Basiswissen bekannt ist.
Offensichtlich hängt dies vom wissenschaftlichen Fortschritt sowie von technologischer, methodologischer, aber auch philosophischer Entwicklung ab, da die Interpretation klinischer Daten in einem klassischen probabilistischen Modell die zugrunde liegende Realität nicht vollständig darstellen kann, da die Variablen abhängig und kompatibel sind, während sie in einem quantenmechanischen Modell unabhängig und inkompatibel sind. Dieser Paradigmenwechsel hätte es uns ermöglicht, detaillierte und frühzeitige Differentialdiagnosen zu stellen, ohne auf das Basiswissen zum spezifischen Thema Capsaicin bei Schmerzen warten zu müssen.
Dieses Kapitel war ein Meilenstein, der den Autor zur Schaffung von Masticationpedia führte, damit diese Fälle rechtzeitig erfasst werden können, um zumindest ein relativ friedliches Lebensende zu gewährleisten und nicht erst nach 10 Jahren Orofazialer Schmerzen (OP) durch Fehldiagnosen gesammelt werden müssen.
Einleitung
Der Hirnstamm ist der kaudale Teil des Gehirns, der das Zwischenhirn mit dem Rückenmark und dem Kleinhirn verbindet.[1] Der Hirnstamm vermittelt die sensorischen und motorischen Bahnen zwischen dem Rückenmark und dem Gehirn und enthält die Kerne der Hirnnerven, das aufsteigende retikuläre Aktivierungssystem (ARAS) und die autonomen Kerne. Er kontrolliert die Hirnstammreflexe und den Schlaf-Wach-Rhythmus und ist verantwortlich für die autonome Kontrolle des kardiovaskulären, respiratorischen, verdauungsmäßigen und immunologischen Systems. Eine Dysfunktion des Hirnstamms kann verschiedene akute oder chronische Schädigungen zur Folge haben, einschließlich Schlaganfall, Infektionen, Krebs, entzündliche und neurodegenerative Erkrankungen. Im Kontext schwerer Erkrankungen kann der Hirnstamm anfällig für verschiedene Schädigungen sein, die als struktureller und nicht-struktureller Ursprung klassifiziert werden können. Eine Hirnstammdysfunktion kann daher zu einer Beeinträchtigung des Bewusstseins, der kardiovaskulären und respiratorischen Insuffizienz und somit zu einer erhöhten Sterblichkeit beitragen[2][3][4][5] und sich insbesondere als Orofazialschmerz (OP) manifestieren. Hirnstammdysfunktion bei kritisch kranken Patienten:Brainstem dysfunction in critically ill patients:
Diese wichtigen Voraussetzungen, die aus einem interessanten Artikel von Sarah Benghanem[6] extrahiert wurden, sind wesentliche Details, die Ausdruck einer klinischen Erfahrung sind, die den Autor des Kapitels zu wissenschaftlichen und epistemologischen Überlegungen über die Art der Sprache geführt hat, die bei der Erstellung von Diagnosemodellen verwendet werden soll, und folglich zur Gründung von Masticationpedia geführt hat. Man kann nicht, wie es die persönliche und verantwortungsbewusste Aussage des Autors der Kapitel zeigt, sklavisch einem Axiom oder einem Protokoll wie dem DRC oder ähnlichem folgen und das Risiko eines Differentialdiagnosefehlers eingehen, der das Leben eines Menschen kosten kann. Wenn es eine Lücke im Modell gibt, die wir während der Implementierung von Masticationpedia nachweisen werden, dann sollte sie als Anomalie vermerkt, analysiert und beseitigt oder zumindest modifiziert werden, sonst handelt es sich nicht um paradigmatischen Fortschritt, sondern nur um intensiven Fortschritt.
Vorstellung des klinischen Falls
Es war das Jahr 1995, als die 60-jährige Patientin, die wir mit einem ausgefallenen Namen "Capsaicin" nennen werden (den Grund werden wir unten verstehen), sich mit bilateralen diffusen Orofazialschmerzen in der Region der Schläfenmuskulatur und im okzipitalen Bereich, zusätzlich zum Vorhandensein von brennendem Mund (BMS), seit mehr als 10 Jahren bei uns vorstellte. Die Schmerzen dauerten stundenlang, besonders nachts, und traten nicht zyklisch auf. Die Patientin trug seit langem eine obere und untere keramische feste Prothesenrehabilitation mit verschiedenen Brüchen der keramischen Struktur und Abrieb-Veneers auf den verbleibenden natürlichen Zähnen. Es wurden jedoch keine Okklusionsdiskrepanzen in der prothetischen Rehabilitation festgestellt, sondern von anderen Gesundheitsfachkräften wurde eine Entlastungsplatte zur nächtlichen Anwendung angefertigt. Die Patientin berichtete auch bei eingelegter Platte über Schmerzen und wurde zunächst als von Atypischen Orofazialen Schmerzen (AOP) mit einem starken psychosomatischen Komponenten betroffen betrachtet und später, gemäß dem RDC-Protokoll, als von 'Temporomandibulären Störungen' betroffen.
Nach unserer Untersuchung, gemäß dem Masticationpedia-Protokoll, wurden die wichtigsten gnathologischen Tests durchgeführt, wie paraokklusale Axigraphie der kondylären Spuren und eine interferenzielle EMG der Massetermuskulatur. In diesem Fall wurde kein ATM-CT angefordert, geschweige denn ein MR. Wir stellen schematisch und repräsentativ einige Absätze aus den vorherigen Kapiteln dar, die das Masticationpedia-Protokoll in seiner Schematisierung als: Aussagen im zahnärztlichen, neurologischen Kontext und schließlich die diagnostische Schlussfolgerung durch den 'Demarcator' vorstellen ':
Bedeutung von Kontexten
Für den "zahnmedizinischen Kontext" haben wir die folgenden Sätze und Aussagen, denen wir einen numerischen Wert zuordnen, um die Behandlung zu erleichtern, und das ist wobei 'Normalität' anzeigt und 'Abnormalität und somit Positivität des Berichts' bedeutet:
Paraokklusales axiografisches Nachzeichnen des rechten Kondylus, negativ in Abbildung 1, Normalität, negativer Bericht
Paraokklusales Axiografie-Nachzeichnen des linken Kondylus, negativ in Abbildung 2, Normalität, negativer Bericht
Symmetrisches EMG-Interferenzmuster in Abbildung 5. Normalität, negativer Bericht
Abbildung 1: Rechtes konsuläres paraokklusales axiografisches Nachzeichnen: a) Zentrum der Scharnierachse, b) Orbitalebeneachse, c) prothetisches Nachzeichnen, d) medioprothetisches Nachzeichnen, e) medioprothetischer Kauzyklusbereich, f) lateroprothetischer Kauzyklusbereich, g) lateroprothetische Rücklinie, h) konsuläre Scharnierachse in maximaler Interkuspidation.
Der Satz (im zahnärztlichen Kontext) zusammen mit einer Anzahl anderer logisch kompatibler Aussagen bestimmen die Vereinigung und Kohärenz zwischen ihnen und werden mit einem mathematischen Formalismus dargestellt, um die diagnostische Dialektik auf folgende Weise zu erleichtern, was den Durchschnitt der einzelnen gemeldeten Behauptungen repräsentiert. Der Durchschnitt wurde gewählt, weil es häufig vorkommen kann, dass einige Tests negative Antworten liefern, denen der Wert zugeordnet wird. Das Ergebnis ist in diesem Fall , was kontextuell die kohärente Bestätigung des Satzes ableitet, in dem argumentiert wird, dass die Symptomatik des 'Capsaicin'-Patienten nicht durch das Vorhandensein von TMDs bestimmt wird.
Im neurologischen Kontext haben wir daher die folgenden Sätze und Behauptungen, denen wir, wie im zahnärztlichen Kontext, einen numerischen Wert geben, um die Behandlung zu erleichtern. Dieser Wert sei , wobei für 'Normalität' und für 'Abnormalität' und damit für die Positivität des Berichts steht:
bRoot-MEPs symmetrisch in Amplitude und Latenz in Abbildung 4, Normalität, negativer Bericht
Kieferruck symmetrisch in Amplitude und Latenz in Abbildung 8, Normalität, negativer Bericht
Symmetrie in der Dauer der Ruheperiode des Kaumuskels in Abbildung 6, Normalität, negativer Bericht
Folglich bestimmen auch im Satz mit einer Anzahl anderer logisch kompatibler Aussagen die Vereinigung und Kohärenz zwischen ihnen und die formale Darstellung wird ähnlich wie die des zahnärztlichen Kontexts sein. mit kontextueller kohärenter Bestätigung des Satzes , in dem argumentiert wird, dass die Symptomatik des Patienten 'Capsaicin' elektrophysiologisch kein Element hervorhebt, das auf eine Korrelation zwischen orofazialem Schmerz und neuromotorischen Schäden hinweisen könnte.
Kohärenz-Demarkator
ChatGPT
Der Kohärenz-Demarkator 𝜏 ist ein repräsentatives klinisches spezifisches Gewicht, das schwer zu erforschen und zu entwickeln ist, da es von Disziplin zu Disziplin und für verschiedene Pathologien variiert. Er ist entscheidend, um logische Aussagen und in diagnostischen Verfahren nicht zu kollidieren und grundlegend für die Initialisierung der Entschlüsselung des Maschinencodes. Grundsätzlich ermöglicht er die Bestätigung der Kohärenz einer Vereinigung im Vergleich zu einer anderen und umgekehrt, wobei er den schwerwiegenden Aussagen und dem Bericht im entsprechenden Kontext mehr Gewicht verleiht. Manchmal steht der Arzt vor einer Reihe positiver Berichte, denen er das richtige Gewicht geben muss. Er muss die Positivität eines Berichts berücksichtigen, der beispielsweise eine osteoartikuläre Erneuerung des Kiefergelenks hervorhebt, kann nicht dasselbe Gewicht haben wie die Positivität eines Berichts, der eine Verzögerung der Latenz eines Trigeminusreflexes bestätigt. Der Demarkationswert gibt daher den schwerwiegenden Aussagen im klinischen Kontext, aus dem sie abgeleitet werden, mehr Bedeutung, und daher müssen die Positivität der Aussagen oder in jedem Fall immer überprüft und respektiert werden. Diese müssen mit einem multipliziert werden, wobei 'geringe Schwere' anzeigt, während 'schwere Schwere' bedeutet.
Ein Kohärenzmarker könnte als eine reelle Zahl zwischen 0 und 1 definiert werden, falls wir mehr als zwei Berichte haben. Eine Zahl nahe bei Null würde einem Bericht von 'geringer Schwere' entsprechen, während eine Zahl nahe bei Eins einem Bericht von 'schwerer Schwere' entsprechen würde. Aber das ist redundant. Was gemacht wird, ist, die Berichte paarweise zu vergleichen und dann die angegebenen Werte zu verwenden, um die 'Schwere' auszudrücken.
Zusammengefasst haben wir:
wobei
Durchschnittswert der klinischen Aussagen im zahnärztlichen Kontext, der in unserem Fall beträgt.
Durchschnittswert der klinischen Aussagen im neurologischen Kontext, und daher .
Bericht über geringe Schwere im zahnärztlichen Kontext.
Bericht über geringe Schwere im neurologischen Kontext.
Dabei wird der "Demarkator der Kohärenz 𝜏" den diagnostischen Weg wie folgt definieren:
Wie wir während der Darstellung der klinischen Fälle in Masticationpeida sehen werden, wird man mit ähnlichen klinischen Situationen konfrontiert sein, bei denen man es mit Orofazialschmerzen zu tun hat, aber die Berichterstattung in Fachkontexten wird geringe Schwere aufweisen, sodass der diskriminierende Wert von aufgehoben wird.
(Die Tatsache bleibt bestehen, dass der Patient weiterhin Orofazialschmerzen erlebt, insbesondere mit Verschlimmerung nach einem würzigen Abendessen.)
In den seltenen, aber realen klinischen Fällen, in denen der ' Demarkator' zurückgesetzt wird, sind wir motiviert, eine noch umfassendere und tiefgreifendere Untersuchung durchzuführen und ernsthafte Pathologien[7][8] zu hypothesieren, einschließlich Kopf- und Hals-Tumoren, die Symptome simulieren können, die sich auf andere Pathologien überlagern können. Es ist ein schwerwiegender Fehler, den Patienten mit solchen klinischen Manifestationen und gleichzeitiger Abwesenheit von systemischen Anomalien als Patienten mit psychosomatischen Störungen zu betrachten. Elemente psychophysischer Schäden können sicherlich nebeneinander bestehen, aber wenn der 'Demarkator' versagt, ist es zwingend erforderlich, die Diagnostik zu vertiefen. Tatsächlich erkranken jedes Jahr weltweit über 890.000 Menschen an Kopf- und Halskrebs (HNC), und die Mortalitätsrate beträgt 50 %. Abgesehen von der schlechten Überlebensrate beeinträchtigen HNC-Schmerzen das Essen, Trinken und Sprechen erheblich und beeinträchtigen dadurch die Lebensqualität stark. Das unterschiedliche Schmerzphänotyp bei Patienten (Allodynie, Hyperalgesie und spontaner Schmerz) resultiert aus einer Kombination von anatomischen, histopathologischen und molekularen Unterschieden zwischen Tumoren.[9] Die gliale und immunologische Modulation des Tumor-Mikroenvironments, wie im Artikel von Ye et al., gut erklärt, beeinflusst nicht nur das Fortschreiten des Krebses, sondern auch die Schmerzsignalgebung, zu denen die in den gustatorischen somatosensorischen Systemen enthaltenen transienten Rezeptorpotenziale ein Beispiel sind.[10][11]
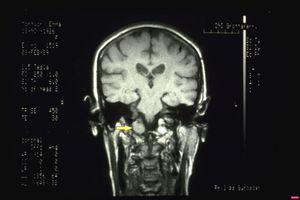
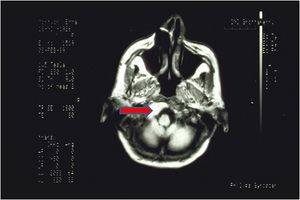
Aus den oben genannten Gründen, der Persistenz der orofazialen Schmerzen, der Schwierigkeit, eine bestimmte Diagnose zu stellen, dem Fehlen von organisch-funktionellen Diskrepanzen und der Nullstellung des ' Demarkators', wurde eine MRT des Gehirns angefordert.
Die Bildgebung zeigte eine neoplastische Masse, höchstwahrscheinlich ein Hirnstamm-Schwannom mit Invagination des Okzipitalknochens. (Abbildungen 7 und 8)
(... und hinterlässt den Zweifel an der Korrelation zwischen Schmerz und Capsaicin, wie vom Patienten bei würziger Nahrung berichtet.)
Gedanken und Schlussfolgerungen
Das Säugetier-Gustationssystem besteht aus Geschmacksknospen, die Ansammlungen von 50-100 Geschmackszellen sind, die sich im gesamten Mundraum befinden. Auf der Zunge, die das zentrale Thema des Fallberichts "Capsaicin" ist, befinden sich die Geschmacksknospen auf den circumvallaten, foliaten und fungiformen Papillen. Geschmackszellen synapsen mit afferenten Fasern von Zweigen des Nervus facialis (CN VII), des Glossopharyngeus (CN IX) und des Nervus vagus (CN X), die wiederum Informationen an das zentrale Nervensystem (ZNS) über gustatorische Attribute, Intensität und hedonische Natur übertragen. [12][13][14] Die Geschmacksknospen sind in einem mehrschichtigen plattenepithelialen Gewebe eingebettet, das somatosensorische Zweige des Trigeminus (CN V), des Glossopharyngeus (CN IX) und des Nervus vagus (CN X) enthält. Informationen von diesen allgemeinen sensorischen Nerven liefern dem zentralen Nervensystem Informationen über mechanische, thermische und Schmerzreize.[11][15] Schmerzhafte Reize können durch starke oder scharfe mechanische Reize, abnormal hohe oder niedrige Temperaturen oder chemische Reize wie Capsaicin verursacht werden, das in scharfen Paprikaschoten vorkommt und durch das Eingreifen von transienten Rezeptorpotentialen (TRPs)[10] ein brennendes Geschmacksempfinden verursacht. Diese TRPs sind in sechs Unterfamilien unterteilt, darunter TRPV1, das für uns interessant ist, um das Phänomen der Schmerzexazerbation des Patienten 'Capsaicin' bei würziger Ernährung zu hypothesieren.
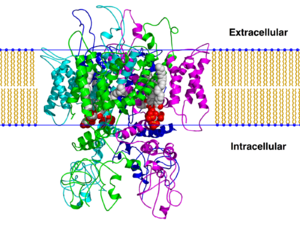
TRPV1 und Neuroinflammation
Transient Receptor Potential dar, die für viele zelluläre Reaktionen verantwortlich sind. Sie werden durch verschiedene Reize aktiviert, wie Säuren, extrazelluläre Protonen, hohe Temperaturen, Pflanzengifte und Vanilloid-Agonisten. Die in Säugetieren vorhandenen TRPV1 können als Sensoren für chemische Substanzen (Capsaicin), thermische Substanzen (Hitze) und/oder schädliche Reize betrachtet werden. Die Aktivierung von TRPV1 führt zur Depolarisation, die für die Propagation von Aktionspotentialen entlang der Axone der Neuronen des Spinalganglions (DRG), die zum Rückenmark projizieren, und folglich auch zu den nozizeptiven trigeminalen Kernen erforderlich ist. Was TRPV1 für die Schmerzsignalgebung so entscheidend macht, ist unbestreitbar seine Fähigkeit, entzündliche Signale in elektrische Signale mit der Aktivierung sowohl von spannungsabhängigen Natrium- als auch Calciumkanälen auf Niveau der Nociceptoren zu übertragen.[16] Die Beteiligung von TRPV1 an pathologischem Schmerz hat eine sorgfältige Untersuchung dieser Proteine angeregt. Das begrenzende Element in der pharmakologischen Forschung auf Anwendungsebene war die Besonderheit des TRPV1-Kanals, d.h. sein polymodaler Aktivierungsmechanismus (Hitze, Capsaicin, pH), was zu einem hohen Maß an Komplexität bei der Gestaltung eines spezifischen Modulationshemmers führte.
Die Interaktion zwischen Neuronen und Immunzellen ist ein bekanntes Phänomen.[17] TRPV1 spielt auch in der Neuroinflammation eine Rolle, indem es sowohl in Neuronen als auch in Immunzellen exprimiert wird. Besondere Bedeutung sollte der bestätigten Expression von TRPV1 in Mikroglia und Astrozyten beigemessen werden, Zellen, die in der Nähe von Neuronen zu finden sind. Die Neuro-Immun-Achse ist der Ort der Produktion neuroinflammatorischer Moleküle und Rezeptoren, die zwischen den beiden Systemen interagieren und eine komplexe Reaktion auf externe Reize (oder auf die eigenen Pathologien des Körpers) gewährleisten. TRPV1 trägt durch sein Ca2+Signal zur Autophagie von Mikroglia bei, was zu mitochondrieninduziertem Zelltod führt. Grundsätzlich ist TRPV1 ein pro-apoptotisches Element.
Liganden
Antagonisten
Antagonisten blockieren die Aktivität von TRPV1 und reduzieren dadurch den Schmerz. Identifizierte Antagonisten umfassen den kompetitiven Antagonisten Capsazepin und den nicht-kompetitiven Antagonisten Rutheniumrot. Diese Wirkstoffe könnten von Nutzen sein, wenn sie systematisch angewendet werden.[18] TRPV1-Antagonisten haben Wirksamkeit gezeigt bei der Reduzierung von Nozizeption aus entzündlichen und neuropathischen Schmerzmodellen bei Ratten.[19] Dies liefert Hinweise darauf, dass TRPV1 der einzige Rezeptor für Capsaicin ist.[20] Bei Menschen könnten Medikamente, die auf TRPV1-Rezeptoren abzielen, zur Behandlung neuropathischer Schmerzen im Zusammenhang mit Multipler Sklerose, Chemotherapie oder Amputation sowie Schmerzen im Zusammenhang mit der entzündlichen Reaktion von geschädigtem Gewebe, wie bei Osteoarthritis, verwendet werden.[21]
Agonisten
TRPV1 wird von verschiedenen Agonisten natürlichen Ursprungs aktiviert.[22] Agonisten wie Capsaicin und Resiniferatoxin aktivieren TRPV1 und führen nach langanhaltender Anwendung zu einer Verringerung der TRPV1-Aktivität (Desensibilisierung), was zu einer Schmerzlinderung durch die anschließende Verringerung der TRPV1-vermittelten Freisetzung von entzündlichen Molekülen bei Exposition gegenüber schädlichen Reizen führt.
Eine interessante Studie der Tominaga-Gruppe erweitert die Liste der TRPV1-Interaktionen auch auf Anoctamin 1 (ANO 1), auch bekannt als Transmembranmitglied 16A (TMEM16A),[23] einen Chloridkanal, der normalerweise durch Ca2+ aktiviert wird. Die Autoren zeigen tatsächlich, dass, wenn TRPV1 mit dem ANO1-Kanal interagiert, dies den Ausstrom von Chlorid vermittelt und Depolarisation auslöst (nach Stimulation durch Capsaicin) mit erhöhter Erregbarkeit des Nociceptors. Tominaga betont einen klaren strukturellen und funktionellen Crosstalk zwischen TRPV1 und ANO1, der bei der algogenen Wirkung von Capsaicin eingreift.
Diese Ergebnisse zeigen die Bedeutung der Chlorid-Homöostase für die Regulation der Erregbarkeit der neuronalen DRGs, d.h. der dorsalen Wurzelganglien, und offensichtlich der trigeminalen somatosensorischen Kerne und des Schmerzphänomens als Ganzes auf; eine der neuen Ansätze, um die schmerzhafte Hypersensitivität und die neurogene Entzündung zu mildern.
TRPV1 wird von mehreren Agonisten natürlichen Ursprungs aktiviert. Agonisten wie Capsaicin und Resiniferatoxin aktivieren TRPV1 und führen nach langanhaltender Anwendung zu einer Verringerung der TRPV1-Aktivität (Desensibilisierung), was zu einer Schmerzlinderung durch die anschließende Verringerung der TRPV1-vermittelten Freisetzung von entzündlichen Molekülen nach Exposition gegenüber schädlichen Reizen führt.
Eine interessante Studie der Tominaga-Gruppe erweitert die Liste der TRPV1-Interaktionen auch auf Anoctamin 1 (ANO 1) , auch bekannt als Transmembranmitglied 16A (TMEM16A),[23] einen Chloridkanal, der normalerweise durch Ca2+ aktiviert wird. Die Autoren zeigen tatsächlich, dass, wenn TRPV1 mit dem ANO1-Kanal interagiert, dies den Ausstrom von Chlorid vermittelt und Depolarisation auslöst (nach Stimulation durch Capsaicin) mit erhöhter Erregbarkeit des Nociceptors. Tominaga[23] betont einen klaren strukturellen und funktionellen Crosstalk zwischen TRPV1 und ANO1, der bei der algogenen Wirkung von Capsaicin eingreift.
Diese Ergebnisse zeigen die Bedeutung der Chlorid-Homöostase für die Regulation der Erregbarkeit der neuronalen DRGs, d.h. der dorsalen Wurzelganglien, und offensichtlich der trigeminalen somatosensorischen Kerne und des Schmerzphänomens als Ganzes auf; eine der neuen Ansätze, um die schmerzhafte Hypersensitivität und die neurogene Entzündung zu mildern.
(... aufgrund des chronischen Schadens an den Nervenfasern des Hirnstamms mit anschließender Veränderung der neuroimmunen Homöostase und des paradoxen kontextuellen Effekts der analgetischen Wirkung von Capsaicin.)
In these cases, as stated in other chapters, we are dealing with an epistemological profile in which the basic knowledge, what we have called (Knowledge Base) corresponds to a temporal limit of scientific information and consequently serious difficulties of differential diagnosis. We had to wait 12 years to reach an ezipathogenetic conclusion overwritten from 1995, a period in which the patient 'Capsaicin' was being treated, to 2007 in which a research gave the elements to suspect the presence of an organic neurological damage with manifestations of pain and burning mouth. Burning mouth syndrome (BMS) is often an idiopathic, chronic intractable pain condition, affecting 1.5-5.5% of middle-aged and older women. We investigated heat and capsaicin receptor TRPV1, and its regulatory nerve growth factor (NGF), in BMS. BMS patients (n=10) and controls (n=10) were evaluated for baseline and post-topical capsaicin pain scores, and their tongue biopsies were immunostained for TRPV1, NGF, and neurofilament structural nerve markers and periphery. Nerve fibers penetrating the epithelium were less abundant in the BMS (p<0.0001), indicating small fiber neuropathy. TRPV1-positive fibers were overall significantly increased in BMS (p=0.0011), as were NGF fibers (p<0.0001) and NGF staining of basal epithelial cells (p<0.0147). There was a significant correlation between baseline pain score and TRPV1 (p=0.0143) and NGF (p=0.0252) fibers. A significant correlation was observed between baseline and post-capsaicin pain (p=0.0006).
- ↑ Hurley RA, Flashman LA, Chow TW, Taber KH. The brainstem: anatomy, assessment, and clinical syndromes. J Neuropsychiatry Clin Neurosci. 2010;22(1):iv. doi: 10.1176/jnp.2010.22.1.iv.
- ↑ Annane D, Trabold F, Sharshar T, Jarrin I, Blanc AS, Raphael JC, et al. Inappropriate sympathetic activation at onset of septic shock: a spectral analysis approach. Am J Respir Crit Care Med août. 1999;160(2):458–465. doi: 10.1164/ajrccm.160.2.9810073.
- ↑ Sharshar T, Porcher R, Siami S, Rohaut B, Bailly-Salin J, Hopkinson NS, et al. Brainstem responses can predict death and delirium in sedated patients in intensive care unit. Crit Care Med août. 2011;39(8):1960–1967. doi: 10.1097/CCM.0b013e31821b843b.
- ↑ Sharshar T, Gray F, Lorin de la Grandmaison G, Hopkinson NS, Ross E, Dorandeu A, et al. Apoptosis of neurons in cardiovascular autonomic centres triggered by inducible nitric oxide synthase after death from septic shock. Lancet Lond Engl. 2003;362(9398):1799–1805. doi: 10.1016/S0140-6736(03)14899-4.
- ↑ Mazeraud A, Pascal Q, Verdonk F, Heming N, Chrétien F, Sharshar T. Neuroanatomy and physiology of brain dysfunction in sepsis. Clin Chest Med. 2016;37(2):333–345. doi: 10.1016/j.ccm.2016.01.013.
- ↑ Benghanem S, Mazeraud A, Azabou E, Chhor V, Shinotsuka CR, Claassen J, Rohaut B, Sharshar T. Brainstem dysfunction in critically ill patients. Crit Care. 2020 Jan 6;24(1):5. doi: 10.1186/s13054-019-2718-9.PMID: 31907011
- ↑ Chloé Gibeili, Arek Sulukdjian, Audrey Chanlon, Nathan Moreau. Unilateral glossodynia as a harbinger of an occult cerebellopontine angle tumour. BMJ Case Report.. 2022 Apr 12;15(4):e249408.doi: 10.1136/bcr-2022-249408.
- ↑ Irappa Madabhavi, Malay Sarkar, K S Sandeep, Mitul Modi. Isolated trigeminal neuralgia: An early weird presentation of carcinoma breast. J Cancer Res Ther. . 2022 Oct-Dec;18(6):1820-1822.doi: 10.4103/jcrt.JCRT_712_20.
- ↑ Advances in Head and Neck Cancer Pain. Ye Y, Jensen DD, Viet CT, Pan HL, Campana WM, Amit M, Boada MD.J Dent Res. 2022 Aug;101(9):1025-1033. doi: 10.1177/00220345221088527. Epub 2022 Apr 13.PMID: 35416080
- ↑ 10.0 10.1 Ramsey, I.S., M. Delling, and D.E. Clapham. 2006. An introduction to TRP channels. Annu Rev Physiol, 68: 619–647.
- ↑ 11.0 11.1 Julius, D. 2013. TRP channels and pain. Annu Rev Cell Dev Biol, 29: 355–584.
- ↑ Gutierrez, R., and S.A. Simon. 2011. Chemosensory processing in the taste-reward pathway. Flavour Fragr J, 26(4): 231–238.
- ↑ Carleton, A., R. Accolla, and S.A. Simon. 2010. Coding in the mammalian gustatory system. Trends Neurosci, 33(7): 326–334.
- ↑ Vincis, R. and A. Fontanini. 2016. A gustocentric perspective to understanding primary sensory cortices. Curr Opin Neurobiol, 40: 118–124
- ↑ Kaneko, Y., and A. Szallasi. 2014. Transient receptor potential (TRP) channels: A clinical perspective. Br J Pharmacol, 171(10): 2474–2507.
- ↑ Bourinet E, Altier C, Hildebrand M E, Trang T, Salter MW, Zamponi GW. Calcium permeable ion channels in pain signaling. Physiol Rev 2014; 94: 81–140.
- ↑ Jacobson A, Yang D, Vella M, Chiu IM (May 2021). "The intestinal neuro-immune axis: crosstalk between neurons, immune cells, and microbes". Mucosal Immunology. 14 (3): 555–565. doi:10.1038/s41385-020-00368-1. PMC 8075967. PMID 33542493.
- ↑ Khairatkar-Joshi N, Szallasi A (January 2009). "TRPV1 antagonists: the challenges for therapeutic targeting". Trends in Molecular Medicine. 15 (1): 14–22. doi:10.1016/j.molmed.2008.11.004. PMID 19097938.
- ↑ Jhaveri MD, Elmes SJ, Kendall DA, Chapman V (July 2005). "Inhibition of peripheral vanilloid TRPV1 receptors reduces noxious heat-evoked responses of dorsal horn neurons in naïve, carrageenan-inflamed and neuropathic rats". The European Journal of Neuroscience. 22 (2): 361–370. doi:10.1111/j.1460-9568.2005.04227.x. PMID 16045489. S2CID 24664751.
- ↑ Story GM, Crus-Orengo L (2008). "Feel the Burn". American Scientist. 95 (4): 326–333. doi:10.1511/2007.66.326. ISSN 0003-0996. Archived from the original on January 19, 2008.
- ↑ Gunthorpe MJ, Szallasi A (2008). "Peripheral TRPV1 receptors as targets for drug development: new molecules and mechanisms". Current Pharmaceutical Design. 14 (1): 32–41. doi:10.2174/138161208783330754. PMID 18220816.
- ↑ Boonen, Brett; Startek, Justyna B.; Talavera, Karel (2016-01-01). Chemical Activation of Sensory TRP Channels. Topics in Medicinal Chemistry. Springer Berlin Heidelberg. pp. 1–41. [1]doi:10.1007/7355_2015_98.
- ↑ 23.0 23.1 23.2 Yasunori Takayama, Daisuke Uta, Hidemasa Furue, and Makoto Tominaga. Pain-enhancing mechanism through interaction between TRPV1 and anoctamin 1 in sensory neurons. Proc Natl Acad Sci 2015; 21; 112(16): 5213-5218. doi: 10.1073/pnas.1421507112. Epub 2015 Apr 6.

![{\displaystyle \delta _{n}=[0|1]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd35df3912a48e5b0b70d9cd5b2e1bee432c3272)












![{\displaystyle \gamma _{n}=[0|1]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f85d0ed73fa3e7903f0321e48668467c1277f4e)
















![{\displaystyle \tau =[0|1]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fbdc534cec0dcf1f070a551e40611eb83e8aca25)